I globuli rossi sono cellule prive di nucleo, a forma di ciambella [1]. Misurano 7 μm di diametro, 2 μm di spessore, hanno una superficie di 135 μm2 ed un volume medio di 90 μm3.
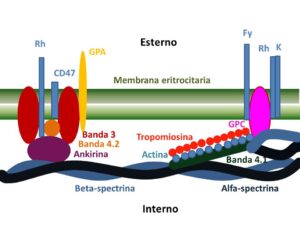
Queste misure si adattano a quelle di un cilindro, ma in circostanze particolari il volume può aumentare anche dell’80%, facendo assumere al globulo rosso l’aspetto e le dimensioni di una sfera; la differenza fra le due forme è evidente, in quanto, nel primo caso il rapporto superficie/volume è pari a 1.5, mentre nel secondo caso è circa 1, cosa che determina una maggiore rigidità. D’altra parte, quando il globulo rosso è costretto a passare attraverso i capillari, che misurano 1/3 del suo diametro, può arrivare ad incrementare questa grandezza nella direzione del flusso fino a 4 volte il valore di riposo. L’elasticità è sostenuta da tre componenti proteiche del citoscheletro: la spectrina organizzata in esagoni, ed è quella che conferisce la forma biconcava al globulo rosso, una molecola di actina collegata alla tropomiosina e coadiuvata dalla proteina della banda 4.1 che costituiscono il complesso contrattile vero e proprio e l’ankirina che aggancia il complesso contrattile e la spectrina al doppio strato lipidico della membrana.
Ogni mL di sangue circolante ne contiene in media 6 milioni nei neonati, 4.7 milioni nei bambini fino ai 12 anni, 4.8 milioni nei maschi adulti e 4.2 milioni nelle femmine adulte. Questo vuol dire che se mettessimo in fila tutti i globuli rossi circolanti, per esempio, in un bambino copriremmo la distanza di 126 chilometri.
La membrana del globulo rosso, cioè l’involucro esterno, è fatto per il 52% di proteine, per il 40% di lipidi, e per l’8% di carboidrati. I lipidi, come in qualsiasi altra membrana citoplasmatica, sono arrangiati in un doppio strato interno ricoperto da uno strato glicidico esterno, il glicocalice ed uno interno di proteine. Nel glicocalice sono contenute la maggior parte delle glicoproteine che formano il patrimonio antigenico gruppo-specifico, le proteine di contatto, soprattutto le I-CAM e altri elementi glicolipidici fondamentali per permettere ai globuli rossi di entrare nella microcircolazione capillare. Sulla superficie esterna del doppio strato lipidico si ritrovano soprattutto fosfatidilcolina (30%) e sfingomieline (25%), mentre nello strato interno sono più concentrate la fosfatidiletanolammina (30%) e la fosfatidilserina (14%); questa configurazione fosfolipidica definisce la cosiddetta “asimmetria di membrana”.
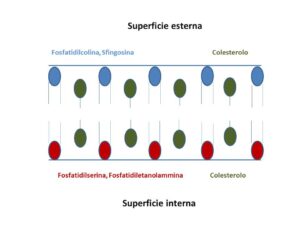
Il colesterolo è situato nella parte centrale del doppio strato, soprattutto in aggregati, i cosiddetti “lipid rafts”, ed è destinato a cooperare nel conservare la struttura e la deformabilità della membrana. Lo strato proteico più interno è formato da enzimi e proteine carrier per gli elettroliti e i metaboliti. Questa è la configurazione chimica che dà stabilità al globulo rosso e ne impedisce la rimozione dalla circolazione. Se per qualsiasi motivo i fosfolipidi dello strato interno si esteriorizzano il globulo rosso non è più riconosciuto “sano” dal sistema ed è eliminato per fagocitosi prevalentemente nella milza. La componente proteica è quella che fornisce gli enzimi per il trasporto di metaboliti e gli antigeni dei gruppi sanguigni
[2].
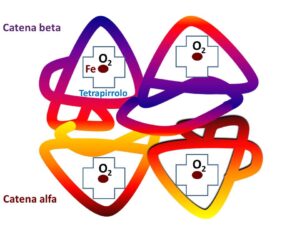
Ogni globulo rosso contiene circa 32 pg di emoglobina; questo fa sì che per ogni mL di sangue ci sono circa 190 mg di emoglobina nel neonato, 150 mg nei bambini fino a 12 anni, 153 mg nell’adulto maschio e 135 mg nell’adulto femmina; poiché l’emoglobina è un pigmento rosso è facile capire perché il sangue assume questa colorazione. L’ingombro dell’emoglobina si aggira intorno al 33% del volume totale del globulo rosso, cioè occupa uno spazio di 30 μm3; poiché il raggio di ogni molecola è di 27.10-4 μm e poiché la forma è grosso modo sferica, il volume di ciascuna molecola è di 82.10-9 μm3, per cui in uno spazio di 30 μm3 saranno ospitate poco meno di 300 milioni di molecole. L’emoglobina pur occupando un volume così ristretto rappresenta ben il 97% del peso secco di ciascun globulo rosso, e si conserva in una sospensione riconducibile ad un fluido newtoniano, per cui anche modesti aumenti della densità di questa sospensione riducono la deformabilità del globulo rosso. L’emoglobina è una molecola formata da una parte proteica detta globina e da quattro gruppi prostetici identici, ciascuno costituito da un anello tetrapirrolico, la protoporfirina IX, con al centro una molecola di ferro (Fe) bivalente (Fe++), legata a quattro residui aminici dell’anello. Questo complesso prende il nome di eme. Il Fe può essere presente anche in forma trivalente (Fe +++), ma in questo caso non lega l’O2. Il Fe rappresenta circa lo 0.32% del peso di ciascuna molecola di emoglobina, quindi la sua quantità per ogni globulo rosso è di 0.11 pg; il ferro contenuto nella masa eritrocitaria corrisponde al 65% del ferro corporeo.
La globina è formata da due coppie di catene amminoacidiche (alfa e beta) per il 97% dell’intero patrimonio molecolare di emoglobina (emoglobina A); un altro 3% è formato da emoglobina A2, in cui la coppia di catene beta è sostituita da una coppia di catene delta. Quantitativi trascurabili raggiunge dopo la 12° settimana dalla nascita l’emoglobina F o fetale, formata da due catene alfa e da due catene gamma. In ogni caso, le doppie catene formano quattro tasche in cui è ospitato l’eme e danno allo stesso stabilità chimica e strutturale. L’informazione genetica per la sintesi delle catene alfa si trova sul cromosoma 16 in ragione di due geni, mentre per tutte le altre catene i geni sono situati sul cromosoma 11, in ragione di uno per tipo, ad eccezione delle catene gamma che hanno due geni codificanti
[3].
La funzione principale dell’emoglobina è quella di trasportare ossigeno dai polmoni agli organi periferici. Ogni grammo di emoglobina lega 1.34 mL di O2, cioè la quantità totale di ossigeno che viene trasportata è di circa 20 mL per ogni 100 mL di sangue arterioso, ammesso che tutti i gruppi eme siano stati saturati. La quantità di sangue che il cuore mediamente riesce a movimentare in 1 min. è di circa 750 mL nel neonato, 1800 mL a 1 anno, 2800 mL a 5 anni, 3900 mL a 10 anni, 5500 mL nell’adulto maschio e 4500 mL nell’adulto femmina, cosa che comporta l’arrivo ai tessuti, in 1 min, di circa 50 mL/Kg di O2 nel neonato, 27 mL/kg a 1 anno, 29 mL/Kg a 5 anni, 22 mL/Kg a 10 anni, 16 mL/Kg nell’adulto maschio e 15 mL/Kg nell’adulto femmina, contro un fabbisogno medio approssimativo di 15 mL/Kg, 7.5 mL/Kg , 7 mL/Kg, 6 mL/Kg, 3.5 mL/Kg e 3 mL/Kg, rispettivamente. E’ evidente che, in condizioni di riposo, esiste una sproporzione macroscopica fra il bisogno reale e quello messo a disposizione dal sangue, sebbene questo squilibrio vada riducendosi man mano che si avanza nell’età. E’ finalizzato al consumo di O2 da parte dei tessuti sia per l’attività fisica e/o mentale sia per la crescita staturo-ponderale del neonato e del bambino.
La capacità dell’emoglobina di legare e cedere O2 è condizionata da alcuni parametri ambientali: la temperatura, la pressione parziale di O2, il pH, la concentrazione del 2,3-difosfoglicerato e dallo stato ossido-riduttivo del ferro. In particolare, t6emperature inferiori a 37 °C diminuiscono l’affinità dell’emoglobina per l’O2 mentre il contrario si realizza per temperature superiori ai 37 °C. Per pressioni parziali di O2 comprese fra 50 e 100 mmHg la saturazione dell’emoglobina si sposta dal 75% al 100%, mentre per pressioni comprese fra lo 0 e i 50 mmHg la saturazione aumenta dallo 0% al 75%; ciò vuol dire che il rapporto fra percentuale di saturazione e pressione parziale di O2 è di 1.5 per i primi 50 mmHg di O2, ma soltanto di 1/3 per i secondi 50 mmHg di O2. L’emoglobina desaturata è tipica della cosiddetta forma T o taut, mentre la forma totalmente saturata è definita forma R o relaxed. Il rapporto R/T è definito dalla relazione
R/T = nlogpO2-nlogp50
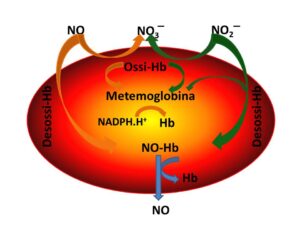
dove n, definito coefficiente di Hill, indica il valore dei siti saturati quando la pO2 è pari a quella che produce il 50% di saturazione. Questo valore è uguale a 3.5 mentre per pO2 prossime allo 0 o molto superiori a quella che produce il 50% di saturazione, cioè un R/T = 0.5, questo valore si aggira intorno a 1. Tutto ciò significa che in presenza di bassissime o altissime pressioni parziali di O2 la saturazione avviene su un solo sito dei 4 disponibili nel primo caso e soltanto sull’ultimo sito nel secondo caso, mentre per pressioni più prossime a quella con R/T = 0.5 la saturazione è molto più rapida e completa, configurando un comportamento sinergico dei siti saturati su quelli da saturare. Quando il pH diminuisce, diminuisce anche l’affinità dell’emoglobina per l’O2, mentre il contrario si verifica se il pH aumenta; questo tipo di comportamento, definito effetto Bohr, è essenziale per aumentare la quantità di O2 che viene rilasciato ai tessuti in caso di abbassamento della pressione parziale dello stesso o quando, per esempio in seguito ad uno sforzo fisico intenso, aumenta la concentrazione degli ioni acidi nel sangue. Un effetto del tutto simile è svolto dal legame della CO2 con l’emoglobina, cosa che si realizza solo per il 10% della quantità totale di CO2 prodotta, ma che in situazioni particolari, come le gravi insufficienze respiratorie, aumenta la forma T dell’emoglobina. Il 2,3-difosfoglicerato è un prodotto intermedio del ciclo metabolico del glucosio all’interno del globulo rosso. E’ prodotto dalla conversione della gliceraldeide-3-fosfato ad opera della bifosfoglicerato-mutasi convertibile in glicerato-3-fosfato ad opera della 2,3-bifosfoglicerato-fosfatasi. Il livello di attività del primo enzima è influenzato dalla pO2, nel senso che a fronte di una diminuzione anche modesta di quest’ultima, come per esempio nell’ascesa ad alte quote o in caso di stati anemici, aumenta l’attività della bifosfoglicerato-mutasi, per cui la gliceraldeide-3-fosfato non viene immediatamente degradata a glicerato-3-fosfato. Infine, perché l’emoglobina possa legare l’O2 è necessario che il Fe nella tasche dell’eme sia mantenuto allo stato di ione Fe++, per cui tutti i meccanismi ossidativi svolti da modificazioni strutturali dell’emoglobina o da farmaci o da sostanze tossiche, che sopravanzano, seppure momentaneamente, i meccanismi biochimici di difesa consistenti nel mantenere lo stato dello ione Fe++, trasformano il Fe++ in ione Fe+++, impedendo di fatto il legame con l’O2. In questo caso si parla di metemoglobina, che non è soltanto una molecola patologica ma fa parte integrante del ciclo dell’NO all’interno del globulo rosso, vero sensore delle necessità di O2 da parte dei tessuti. Infatti, il globulo rosso riesce a regolare il flusso sanguigno nei capillari con due meccanismi fondamentali: la liberazione di NO dal nitrito e la liberazione di ATP, oltre al riciclo dell’NO assorbito da quello liberato dall’endotelio.
Per mantenere stabile l’emoglobina, ma anche per conservare l’equilibrio di membrana, dei metaboliti e degli elettroliti, il globulo rosso consuma energia chimica, che prende dalla via metabolica della glicolisi anaerobia, cioè dalla degradazione di 1 molecola di glucosio in 2 molecole di piruvato. Durante questo ciclo è prodotta energia chimica sotto forma di ATP, che è utilizzato in particolare per mantenere l’asimmetria di membrana tramite le flippasi ATP-dipendenti. Da una molecola di glucosio metabolizzata tramite il ciclo dei pentoso-fosfati ricava 2 molecole di NADH.H
+ e 2 molecole di NADPH.H
+,un coenzima ridotto fondamentale per garantire la stabilità dell’emoglobina nella componente Fe. Infatti, la citocromo b5-ossido-reduttasi usa come coenzima attivo il NADH.H
+ per mantenere il Fe allo stato bivalente. Così, il NADPH.H
+ è essenziale, come coenzima, per ridurre il glutatione ossidato e renderlo disponibile per mantenere i gruppi sulfidrilici della membrana e dell’emoglobina allo stato ridotto; questo meccanismo di stabilizzazione dell’emoglobina sembra essere meno importante per mantenere le sacche dell’eme in condizioni fisiologiche
[4].
I globuli rossi durano in circolo 120 giorni, dopo di che sono rimossi dalla circolazione. In realtà circa il 15% non raggiunge questa età perché sono distrutti durante la loro vita da fenomeni meccanici di schiacciamento e stiramento all’interno dei territori microvascolari soggetti a pressione esterna o su superfici vascolari interne non regolari. I meccanismi che sono stati proposti per spiegare la distruzione programmata dei globuli rossi sono numerosi ma nessuno spiega in maniera esaustiva questo fenomeno. Il dato più rilevante è che i globuli rossi vecchi hanno una densità maggiore dei globuli rossi giovani. Da che cosa derivi questa caratteristica fisica non è dato di sapere. Non sembra essere in giuoco l’invecchiamento degli enzimi deputati al metabolismo energetico e quindi non sembra essere in giuoco una carenza di molecole fornitrici di energia chimica come l’ATP o i coenzimi ridotti NADH.H
+ e NADPH.H
+. Una valore maggiore è attribuito, invece, all’entrata del Ca
++ all’interno del cytosol con una corrispondente uscita di H
2O e K
+, con uno squilibrio che sostiene soprattutto una maggiore rigidità del globulo rosso. E’ stata dimostrata anche una perdita di carboidrati di membrana, ed in particolare di acido sialico, capace di neoformare glicopeptidi tipici della senescenza, che costituiscono uno dei segnali capaci di attivare la fagocitosi macrofagica. Molto significativa sembra anche la polimerizzazione di proteine del citoscheletro, come la spectrina e della membrana come la banda 3, conseguenza diretta dello stress ossidativo a cui il globulo rosso è soggetto per il continuo andirivieni dell’O
2, molecola ad altissimo potere ossidante. Contro i polimeri della banda 3 sono stati ampiamente descritti anticorpi specifici, presenti in tutti i soggetti sani, ma in quantità molto contenuta e comunque incapaci di spiegare completamente la distruzione programmata dei globuli rossi. L’ipotesi che sembra più verosimile, sebbene ancora in fase di studio, è quella che individua alla base dell’invecchiamento eritrocitario la perdita dell’asimmetria di membrana, per riduzione di attività delle translocasi specifiche che garantiscono la concentrazione degli aminofosfolipidi sulla superficie interna della membrana; la esteriorizzazione conseguente di questi fosfolipidi è il segnale che attiva i macrofagi a rimuovere i globuli rossi; resta da stabilire come le translocasi perdono la loro funzionalità secondo un programma ben preciso
[5].Il 15% dei globuli rossi che viene distrutto in sede intravascolare libera emoglobina, che è rapidamente complessata in modo irreversibile dall’aptoglobina, una molecola proteica di origine soprattutto epatica, che ha il compito di impedire che l’alto potenziale ossidativo dell’emoglobina possa danneggiare soprattutto il rene. Ma la gran parte dei globuli rossi invecchiati è fisiologicamente rimossa in sede extravascolare, nella milza, ed in minor misura nel fegato e nel midollo osseo ad opera dei macrofagi. In questa loro funzione i macrofagi svolgono un ruolo assolutamente centrale nell’emopoiesi. La componente proteica dell’emoglobina è degradata ad aminoacidi, mentre i gruppi eme seguono un destino ben preciso. Una parte di essi entra all’interno del nucleo e tramite la complessazione con un fattore repressore, il Bach-1, attiva la trascrizione genica sia dell’eme-ossigenasi 1 sia della ferroportina. L’eme-ossigenasi, rompe l’anello tetrapirrolico, produce CO, unica sorgente fisiologica di CO nell’organismo umano, libera il Fe dall’eme come Fe
++ ed avvia queste due molecole a due destini metabolici diversi. Il Fe in parte entra nel pool del Fe di deposito, sottoforma di ferritina, in parte, tramite la ferroportina, è condotto in superficie e liberato in circolo
[6]. L’eme linearizzato e privo di Fe è definito biliverdina, che subisce un’ulteriore ossidazione a bilirubina ad opera di una reduttasi specifica. La bilirubina lascia il macrofago e tramite il circolo ematico giunge al fegato complessata con l’albumina, la principale molecola capace di legare la forma non coniugata della bilirubina.
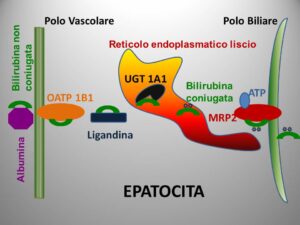
La cellula epatica acquisisce la bilirubina tramite l’OAP 1B1, una proteina di trasporto per gli anioni organici, e veicola la medesima tramite la ligandina, all’interno del reticolo endoplasmatico liscio. In questa sede la bilirubina subisce l’azione di una UDP-glicuronil-transferasi, la UGT 1A1, per mezzo della quale, grazie a due molecole di glicuronato, la bilirubina diventa una molecola idrosolubile ed è escreta al polo biliare dell’epatocita per opera di un trasporter canalicolare ATP dipendente, la MRP2 (Multidrug Resistance Protein 2); attraverso, poi, il circolo biliare è immessa nel piccolo intestino
[7]. La flora batterica del colon degrada in parte la bilirubina coniugata per mezzo delle glicuronidasi, per cui poco meno di 1/7 della bilirubina coniugata ricevuta dal fegato è ritrasformata in bilirubina non coniugata e inviata dalle cellule intestinali al fegato, di nuovo sottoforma di complesso con l’albumina, mentre il resto è degradato soprattutto a urobilinogeno, un pigmento privo di colore che per il 15% è riassorbito e mandato al fegato, il quale, senza ulteriori coniugazioni, lo immette nella circolazione sistemica, attraverso la quale giunge al rene dove è filtrato e ossidato a urobilina, la sostanza che contribuisce di più al colore tipico dell’urina. L’85% dell’urobilinogeno fecale è convertito ad urobilina dalla medesima flora batterica intestinale, e insieme ad altri pigmenti come la mesobilina e la stercobilina, sempre derivati dal catabolismo della bilirubina, conferisce al bolo fecale il suo tipico colore marrone.
Da 1 gr di emoglobina si generano circa 35 mg di bilirubina, per cui in un giorno sono prodotti in media 350 mg di bilirubina; la quantità di stercobilina prodotta in un giorno è in media di 200 mg, quindi circa 1/3 della bilirubina prodotta non è degradata o riconvertita in sede intestinale. Questa notevole quantità è inattivata ad opera della luce in molecole idrosolubili di piccole dimensioni, come le idrossirubine e le bilicresine, ad opera di una mono-ossigenasi specifica associata al microsoma P448.
Conclusione: i globuli rossi sono cellule anucleate, le cui caratteristiche strutturali della membrana e del citoscheletro dei quali garantiscono la loro estrema elasticità. Il volume di ciascun globulo rosso è interamente occupato dall’ emoglobina, una molecola proteica complessa formata da due coppie di catene aminoacidiche e da quattro gruppi eme, ciascuno dei quali è costituito da un anello tetrapirrolico e da una molecola di Fe. L’emoglobina trasporta l’O2 nel sangue e la sua funzione di cessione dello stesso ai tessuti dipende dalla temperatura, dal pH, dalla concentrazione della CO2 e del difosfoglicerato. Il globulo rosso è anche un veicolatore di sostanze vasodilatanti, come l’ATP e l’NO, che scambia mutuamente con l’endotelio dei capillari. L’energia chimica essenziale a mantenere la stabilità della membrana e dell’emoglobina deriva dal metabolismo anaerobico del glucosio. Dopo 120 giorni di vita i globuli rossi sono rimossi dal circolo ad opera dei macrifagi, soprattutto della milza, con recupero del Fe, degli aminoacidi delle catene dell’emoglobina e la produzione di bilirubina che fa seguito alla degradazione degli anelli tetrapirrolici dei gruppi eme.
Bibliografia
1 – Diez_Silva M, Dao M, Han J, Lim CT, Suresh S. Shape and biochemical characteristics of human red blood cells in health and disease. MRS Bulletin 2010; 35:382-388
[full text]2 – Mohandas N, Gallagher PG. Red cell membrane: past, present, and future.
[full text]3 – Perutz MF. Molecular anatomy and physiology of hemoglobin, in Steinberg MH, Forget BG, Higgs DR, Nagel RL Disorders of hemoglobin, Cambridge University Press 2001, pp.174-96
[full text]4 – Greer J, Foerster J, Rodgers GM, Paraskevas F, Glader B, Arber DA, Means RT Jr. Wintrobe’s Clinical Hematology,volume 1, Wolters Kluver Health, Lippincott Williams & Wilkins, Philadelphia 2009, pp. 148-55
[full text]6 – Beaumont C. Multiple regulatory mechanisms act in concert to control ferroportin expression and heme iron recycling by macrophages. Haematologica 2010;95:1233-36
[full text].7 – Fewery J. Bilirubin and clinical practice: a review. Liver International 2008, 592-605
[full text]






